一、目的
過往由於等待器官捐贈的病例數量遠超過腦死捐贈者,促使世界各國開始發展活體捐贈與心臟(循環)停頓死後的器官捐贈(Donation after circulatory death, DCD);對於心臟死後器官捐贈的共識,台灣於2017年10月6日由衛生福利部醫事司石崇良司長以新聞稿對外宣布:國內心死後器捐已有足夠之規範可遵循與執行;衛生福利部的公文及作業參考指引亦於2017年12月26日發送至各相關單位,至此台灣正式進入由衛生主管機關背書可執行DCD手術的國家之列。因筆者於2015年赴美進修外傷與移植相關領域時曾有參與DCD手術的臨床經驗,且此項目之推動需要一整個團隊的合作與詳盡細節規劃,院內長官自今年初即鼓勵筆者尋找國際上對DCD執行較具規模的器官移植中心,最終選定了倫敦國王學院醫院做為期一個月的短期進修;期間有感於心死後器捐的推動需要全體醫界同仁的理解與協助,故藉此園地撰文,希望能與本院所有可能接觸到重症或疾病末期的醫師、以及有志於此的移植醫師分享交流心得,共同集思廣益建構出適用於台灣環境的DCD標準化作業流程。
二、心得
心死後器捐早期被稱為無心跳(non-heart beating)捐贈,最初始的器官移植也多以心臟停止來做為死亡判定方式,但隨著1976年腦死判定流程有明確的規範後,著眼於DCD的器官品質往往因為較長的溫缺血傷害而受損,國際上遂轉以腦死後器捐(donation after brain death, 簡稱DBD)作為主要的器官捐贈來源。然而世界各國卻很快發現器官來源數往往不足以提供給等待器官救命的病人,在發展人工器官與幹細胞培育研究的同時,亞洲國家包括台、日、韓乃致力於手術精準度要求更高的活體器官捐贈手術,西歐國家包括荷、比、英、法、西則著手改良DCD手術的器官保存技術以及降低溫缺血傷害的方法。
當人生跨越終點線時,心電圖上那一長條直線雖宣告了心臟已經停止跳動,但此過程是在哪裡發生、搶救期間又經過了什麼樣的處置?這些外在因素都對DCD的器官功能有著極深的影響!因此國際上在1995年以Maastricht classification將DCD分為四大類(如表1),此四類可再歸納為在嚴密觀察控制(controlled)下發生的心跳停止與在無法監測控管(uncontrolled)的醫院外或急診急救環境下所發生的心跳停止等二大組;訪察期間適逢有來自西班牙的進修醫生,經詢問大致得知西班牙的作法是到院前死亡的病人經急救無效後,醫院立即致電值班的地方檢察官,檢察官在電話上如認為無其他可疑,即批准執行uncontrolled DCD的準備,此時值班醫師會立即自右側腹股溝處置入V-A葉克膜,另在左側腹股溝置入一主動脈球囊阻擋含氧血往頸動脈以上灌注,待家屬抵達後經醫生解說並同意捐贈時,才將捐贈者送往手術室。
表一: 馬斯垂克分類(Maastricht Classification of DCD)
|
類別 |
組別 |
潛在捐贈者的狀況判別 |
|
I |
Uncontrolled:事前的外在條件難以控制 |
到院前死亡者 |
|
II |
Uncontrolled:事前的外在條件難以控制 |
在醫院經急救處置但未成功者 |
|
III |
Controlled:執行前的外在條件可控制監測 |
因疾病末期執行維生系統撤除措施者 |
|
IV |
Controlled:執行前的外在條件可控制監測 |
於腦死的情況下心臟停止 |
有別於西班牙的部分醫學中心已積極採用uncontrolled donor,英國所採用的是Maastricht category III的controlled DCD,且不得為保存器官功能而於病人死亡前預先置入葉克膜(ECMO)體外循環系統,目前國內將推行的DCD捐贈模式也是以此類為主;英國的DCD捐贈者數量在其所有大愛捐贈中所佔的比例,自2000年僅5%到2010年時即達到35%,至2015年更是已有近三分之一的腎臟移植手術來自於DCD捐贈者,且腎臟移植的成效在長期追蹤報告中也與DBD相當!(圖一)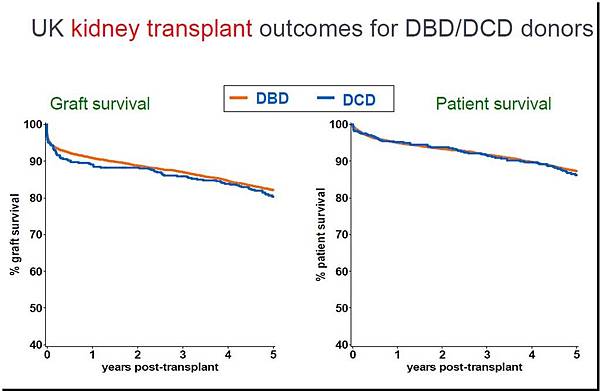
由於每年在英國執行大愛器官捐贈的手術量僅1700例,且DCD手術的流程更是分秒必爭,在不得為保存捐贈器官考量而使用葉克膜的前提下,為維持手術操作速度與摘取器官的品質,英國政府在全國設立了七個團隊專責執行大愛器官的捐贈手術,以利外科醫師在有限的捐贈例數下仍能有足夠的手術經驗。根據官方最新(2016~2017)的年度報告顯示,此次進修的倫敦國王學院醫院(King's College Hospital)為全英國執行腹腔器官摘取手術量最大的團隊,進修期間除了參與協助捐贈手術、學習DCD器官在移植手術上的注意事項,更有幸觀摩到DCD的心臟摘取手術,唯此方案是否合乎目前衛生福利部對無心跳器官捐贈所建議之指導原則,仍有可議之處;然而在心臟與腹部摘取團隊的通力合作下,於劃刀後10分鐘內完成體外循環系統的建立並進一步評估器官功能是否能夠移植,在觀念上與目前歐美致力發展中的器官常溫灌流其實頗有異曲同工之處,若在法規與經費等條件皆許可的前提下,我們執行DCD的同時亦可參考國外的作法,規劃與器官保存方法及缺血傷害後功能檢測相關之基礎研究與臨床試驗。
對於捐贈器官品質的評估,除了年齡、血液生化數據、尿液排出量、動脈氣體分析、影像檢查資料之外,手術中對於肝臟的脂肪肝程度與肺臟的支氣管鏡檢查,也是很重要的評估依據,但對於腹腔臟器影響最直接的仍是功能性溫缺血時間(functional warm ischemia time, 簡稱f-WIT)!根據英國NORS的共識,f-WIT的起始時間定義為血氧濃度小於70%或收縮壓低於50mmHg,兩者只要有任一項達標即開始計算,各器官能忍受的f-WIT為:肝臟30分鐘、胰臟30分鐘、肺臟60分鐘、腎臟120分鐘,如f-WIT超過該器官的臨界值則不執行摘取(若時間上許可會電話向移植端醫師確認),但f-WIT若剛好在臨界值附近,則還是盡可能以最短時間先完成摘取後,再向移植端醫師電話確認是否使用。以肝臟而言,我在英國所跟隨的指導醫師認為,若能儘量縮短冷缺血時間且肝臟品質較好,甚至可以容忍f-WIT長達40分鐘。另外,病人於撤除維生系統後若持續未達到功能性溫缺血的閾值,且撤除時間已超過一小時,則肝臟與胰臟即視為無法摘取,當超過兩小時則需根據生理數值重新評估是否摘取腎臟,如認為腎臟仍堪使用,則最長可再多等候兩小時。
英國的DCD病人多來自於加護病房,由於倫理上的考量,移植醫師完全不參與任何病人確認已死亡前的醫療決策、病情解釋或同意書的簽署,維生系統撤除期間亦不會給予肝素(heparin);若最終沒有任何器官達到摘取條件的話,手術團隊在確認無可摘取之器官後即行離開手術室,病人則視其當時的生命徵象進程,由該醫院之麻醉及重症醫師決定是留置於撤除維生系統的地點或送回原加護單位觀察。手術前的準備工作及資料核對均比照DBD流程,惟手術器械在準備時應先擺好一組從劃刀至完成灌注管置入的簡易工具組(圖二),主刀醫師更需在手術前再三確認第一助手、刷手護理師及循環師(流動人員)完全了解執行每個步驟時所需協助的動作及手勢,如此才能確保團隊能在劃刀五分鐘內開始灌注器官保存液的目標。在執行維生系統撤除的過程中,NORS有一個輸入資料的網路介面可即時更新病人的生命徵象紀錄,不僅可確保所有流程及資料有完整的紀錄,過程中手術醫師也可透過ipad隨時連線查閱,移植協調師也會在病人端與醫師端之間來回走動或以電話/短訊告知最新近況。
圖二: 手術前的器械擺設與準備(左上及左下圖為精簡後,自劃刀以至器官保存液開始灌注所需的器械及擺設)

當病人心臟停止五分鐘後,捐贈手術始可執行,手術切口自胸骨上緣劃至恥骨聯合上,並自下腹部劃入腹腔內,在分離肝圓韌帶後立即以線鋸或電鋸切開胸骨,架上胸骨及腹壁撐開器後先將下腔靜脈剪開釋放靜脈血液並持續抽吸引流,接著進行腎下腹主動脈的灌流管置入,並以200mmHg的壓力開始灌注加有2萬單位肝素(Heparin)的器官保存液,緊接著找出肝門靜脈或下腸繫膜靜脈來置入第二條導管,以使肝臟的保存液灌注效果能達到最好;在各器官周圍倒入碎冰並確認保存液的灌注成效後,馬上進行肝門處的膽管(含沖洗)、肝動脈、肝門脈分離,儘可能在30分鐘內將肝臟取出來進行下一階段的保存液灌注;然後再依序取出胰臟、腎臟並做進一步的保存液灌注。一般而言,劃刀至主動脈開始灌注的時間需控制在5分鐘內,在沒有體外循環系統的情況下,各器官以能儘早離體為佳,NORS對後續的保存液灌注量亦有規定可遵循。
誠然,DCD的器官功能維護與可用性評估、受贈者之病情解釋分析(Donor & Recipient Risk Index之計算)、病人前置作業及後續處理流程上,仍有許多細節需要依國情不同再多加思量;在病人與家屬端,考量台灣的醫病關係與保險制度,如何向潛在的DBD或DCD病人家屬解釋持續地積極治療已無助於病情改善與功能恢復,對於主責的照顧醫師也是一大挑戰!在英國期間亦觀察到有少數病人雖已沒有腦幹反應,但家屬卻拒絕進行腦死判定,只肯接受以心臟停止來做為死亡的判定(參見圖三),顯示部分家屬對於腦死即死亡的接受程度,其實反不如心臟停止跳動來得坦然;又究竟DCD是否會壓縮到DBD的捐贈數量?雖然目前國際上的文獻多認為不會,但在不同的風土民情下,這個論點成立與否仍有待觀察。不過我們也應思考,既然國內的器官捐贈在心臟停止後已成為可行,是否會有更多無法接受腦死定義的家屬,願意在死亡過程已無法扭轉、繼發性的感染與器官衰竭出現前,選擇在見證確認病人的心臟已自然停止後,多一個救治幫助其他病患的機會呢?
圖三: 英國由病人家屬同意執行者DBD與DCD之人數變化,可見經家屬同意的DCD捐贈人數,自2010年(圖中圓圈標示處)後即超越DBD人數,且數目仍在逐年升高中,相較之下DBD的數量在近年雖有增加但成長幅度趨緩。(www.odt.nhs.uk)

台灣於2015年12月完成立法,通過亞洲第一部「病人自主權利法」的專法,除了確保讓病人有知情和選擇權,也讓病人自己有權可以拒絕無效醫療。每個處於生命終期病人都有選擇安寧療護的權利,而醫護人員則有能力協助其達成心願;若是選擇安寧療護的生命終期病人或是無法順利執行腦死判定的重症病患,希望能在死後將有用的器官捐贈給需要的人時,藉由「心死後」的器官捐贈方式與相關團隊的密切合作,我們將有機會幫助他們「移愛」人間。願所有費心讀完這篇文章的醫界同仁,能夠認同心死後器官捐贈的願景,讓我們在每位病人的生命花園中,扮演好最稱職的園丁角色,期使每位臨終病人都能在信仰、希望、與愛的祝福下走完生命最終的道路。
三、 建議事項
DCD病人在病情上可能較腦死病人更快速變化,器官在撤除維生系統的流程中亦會因溫缺血時間(f-WIT)與後續手術操作過程不同,對器官的可利用性與安全性造成極大影響與差異;手術技巧上應持續培育更多年輕外科醫師,熟悉如何快速處置胸腹主動脈、門靜脈及下腔靜脈之能力,如此將能提升消化系外科醫師對急症外傷與移植手術之操作能力。英國為了提高器官摘取手術之操作水平與器官品質,設立了執行器官摘取的特定團隊並定期(每月)檢討成效,在各方建立互信與共識後,此運作模式對於資源較有限的國家,不僅能有效運用人力,更能確保手術是由累積有豐富經驗且合作默契佳之團隊來執行;而這樣的區域性合作模式也與近日衛服部為解決重症醫師不足,所提出的跨院聯合值班概念頗有雷同之處,且可行性還比設備移動機動性較低的心導管室來得高,值得衛生主管機關審慎評估與規劃。
對於受贈者的選擇與決策時間限制,此點不僅需要器官分配系統的有效及迅速運作,還須倚靠各醫院協調師之間的密切溝通,更需參考國內器官移植分配系統之規範與現行之作業流程,並針對DCD業務加強協調師之訓練。由於英國有非常完整且經過認證的協調師團隊,所以移植手術醫師能確實地透過協調師傳遞意見,且鑒於移植醫師在倫理及法理上不得參與捐贈端的決策流程,英國的急重症醫師(臨床決策與病情解釋)及麻醉醫師(須全程參與維生系統撤除過程)在DCD捐贈過程中的責任更顯得相對吃重;對於急重症團隊、麻醉團隊及安寧照護團隊,除了持續由移植團隊發起溝通和定期進行推廣之外,衛生主管機關如能給予適時、適當的獎勵,想必能對器官勸募過程中的所有團隊成員,產生積極正面的鼓勵效果。


 留言列表
留言列表

